1.
Faire passer un filet de mandarines…pour un implant vaginal. C’est précisément qu’a fait une journaliste néerlandaise auprès d’un organisme de certification pour obtenir un accord de principe pour un marquage CE !
Depuis, la presse se déchaîne contre le système de certification des dispositifs médicaux implantables (DMI) en Europe, en général, et l’ANSM, la CNAM et les ’’organismes notifiés’’ (ou ON, c’est-à-dire des organismes d’évaluation de la conformité du produit aux exigences générales en matière de sécurité et de performances), en particulier. La ministre de la santé et des Solidarités met en cause, quant à elle, les professionnels de santé chargés de procéder aux signalements des incidents dans le cadre de la matériovigilance.
La presse se fait l’écho des principaux griefs suivants : absence de suivi rigoureux des incidents, opacité du recueil d’informations ou non-publicité des données recueillies rendant impossible toute évaluation sérieuse des risques liés à ces implants, impossibilité de connaître le nombre et le type de DMI présents dans la population française.
En réalité, la matériovigilance ne repose pas sur un seul acteur mais sur une chaîne de responsabilités, qui est clairement exposée au code de la santé publique : 1° Signalement et enregistrement des incidents ou des risques d’incidents ; 2° Enregistrement, évaluation et exploitation de ces informations dans un but de prévention ; 3° Réalisation de toutes études ou travaux concernant la sécurité d’utilisation des dispositifs médicaux ; 4° Réalisation et suivi des actions correctives décidées.
En somme, chacun doit (ou devrait) jouer son rôle : l’ANSM, le correspondant local de matériovigilance, le fabricant (ou son mandataire), « les utilisateurs ou les tiers qui font la constatation ou qui ont connaissance d’incidents ou de risques d’incident mettant en cause un dispositif médical » (art. R.5212-16 du Code de la santé publique).
Or, ce que la presse dénonce aujourd’hui, la Commission européenne le dénonçait depuis déjà 10 ans, notamment la manière dont les organismes de certification étaient désignés par chaque État membre de l’Union européenne. Elle soulignait le manque de transparence dans les certifications des DM, dénonçait le manque d’intégrité de certains ON voire leur manque de compétence ou de rigueur. Il faut dire que le marché des ON est fortement concurrentiel et non exempt de conflits d’intérêt.
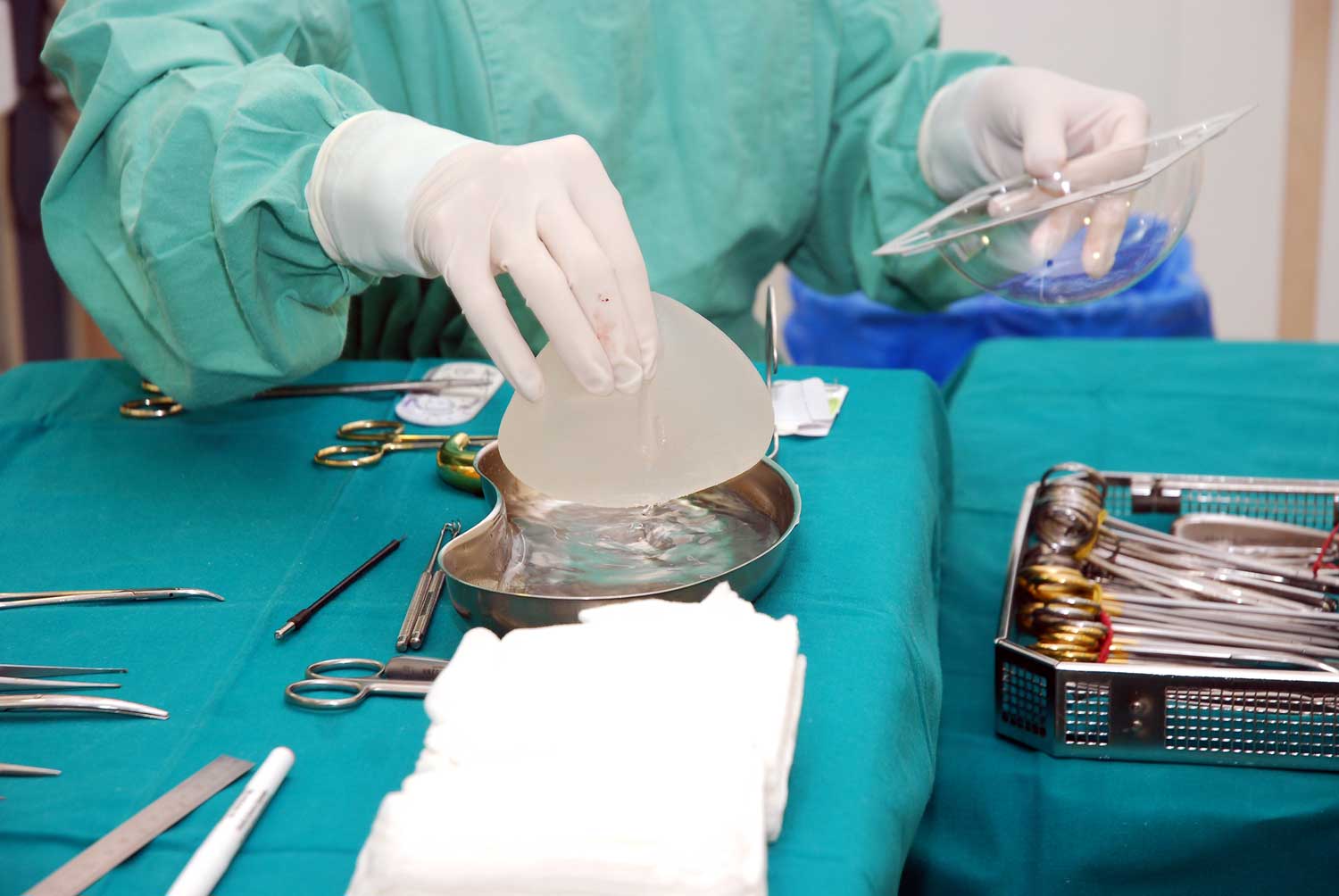
Les scandales à répétition, tels que l’affaire des implants mammaires PIP et celle des prothèses de hanche ASR, ont conduit la Commission européenne à proposer une refonte de la législation des dispositifs médicaux afin de mettre l’accent sur la sécurité des personnes.
C’est précisément l’ambition affichée par le nouveau règlement 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux, publié le 5 mai 2017, entré en vigueur le 26 mai 2017 et d’application obligatoire… à compter du 26 mai 2020.
Ce texte apporte de nombreuses nouveautés dans le détail desquelles il est présentement impossible d’entrer. Ce sera l’objet du volet n°2 de cet article.
2.
En fait de dispositifs médicaux, l’histoire semble être un éternel recommencement.
Que l’on songe à l’affaire américaine des stérilets Dalkon Shield, dispositifs intra-utérins à l’origine de graves complications chez plus de 200.000 femmes (dont une vingtaine sont décédées). Ces faits se sont déroulés dans les années 70 et ont donné lieu à une class action (action de groupe) de grande ampleur qui a abouti à une transaction de plus de 2,5 milliards de dollars.
Fondé sur les articles 114 et 168 du Traité fondateur de l’Union européenne, le règlement UE 2017/745 a pour objet d’établir un statut relatif à la mise sur le marché des dispositifs médicaux au sein de l’UE. Ce texte opère une distinction entre trois catégories de dispositifs : les dispositifs implantables (ex : prothèses mammaires), les dispositifs invasifs (ex : sondes) et les dispositifs actifs (ex : logiciels).
Il ajoute également les réactifs parmi les éléments matériels de la définition du DM, laquelle repose sur deux critères essentiels : la finalité et le moyen. Il doit s’agir d’un moyen de nature physique, le plus souvent mécanique, associé le cas échéant à une source d’énergie, pour une finalité médicale précise.
Le règlement apporte des modifications concernant les règles concernant en particulier le marquage CE (clé de voûte de la réglementation des DM), la mise sur le marché et la mise en circulation des DM, la traçabilité, la classification, l’évaluation de la conformité, l’évaluation et les investigations cliniques, la vigilance.
S’ils conservent leurs obligations originelles (conception et fabrication des DM conformes, élaboration d’une documentation technique, maintien de la conformité), les fabricants se voient imposer de nouvelles obligations en matière d’évaluation clinique. Ils doivent disposer d’une personne qualifiée chargée de veiller au respect de la réglementation (conformité des produits, établir et mettre à jour la documentation technique et la déclaration de conformité, surveillance post-commercialisation et matériovigilance) et chargée de faire le lien avec les autorités compétentes en cas de contrôles ou d’investigations.
S’ajoutent également des obligations liées à l’apposition obligatoire du système d’identification unique (UDI) – c’est-à-dure une série de chiffres ou de lettres créée selon les normes internationales d’identification et de codifications des dispositifs et qui permet l’identification formelle de dispositifs donnés sur le marché – qui devra être enregistrée dans la base de données EUDAMED, sur tous les dispositifs médicaux et dont il appartiendra à chaque opérateur économique successif d’en vérifier le respect.
Désormais, si une autorité compétente considère ou a des raisons de croire qu’un dispositif a causé un dommage, « elle facilite la communication, sur demande, des informations et des documents (…) au patient ou à l’utilisateur ayant potentiellement subi un dommage et, le cas échéant, à son ayant droit, à sa compagnie d’assurance ou à d’autres parties tierces concernées par le dommage causé au patient ou à l’utilisateur ».
Cette disposition impose aux autorités compétentes de remettre aux utilisateurs finaux qui le demandent, tout document utile sur le dispositif litigieux.
En ce qui concerne les fabricants qui ne sont pas établis dans l’Union européenne, le mandataire (dont la désignation est dans ce cas obligatoire) joue un rôle crucial en ce qu’il veille à la conformité des DM produits par ces fabricants. Il leur sert d’intermédiaire dans l’UE.
Si, malgré un mandat écrit, le fabricant ne peut déléguer ses propres responsabilités sur son mandataire, ce dernier endosse toutefois un certain nombre d’obligations qui font de lui une sorte de sentinelle de la conformité UE vis-à-vis des autorités, quitte pour ce dernier à mettre un terme à son mandat dans l’hypothèse où le fabricant ne respecterait pas les obligations issues du règlement. Une substitution de mandataire reste possible sous certaines conditions.
Le règlement prévoit une responsabilité solidaire du mandataire et du fabricant en cas de défectuosité des DM, le mandataire étant « juridiquement responsable des dispositifs défectueux au cas où un fabricant établi en dehors de l’Union n’a pas satisfait à ses obligations générales ».
Reste à aborder les rôles respectifs de l’importateur et du distributeur pour finir par évoquer les conditions de surveillance des organismes certificateurs. Ce sera l’objet du volet n°3 de cet article.
3.
Le règlement européen change la donne également en ce qui concerne l’importateur est le distributeur. Auparavant, les directives ne visaient pas directement ces opérateurs clé dans la chaîne d’approvisionnement du dispositif médical.
Dorénavant, le règlement a pour effet que chacun des opérateurs économiques impliqués doit vérifier que le précédent opérateur intervenant dans la chaîne a agi conformément au règlement. Ainsi, importateurs et distributeurs doivent, préalablement à toute mise sur le marché du DM, s’assurer que le DM soit lui-même conforme aux exigences de règlement.
Chargé de mettre sur le marché européen des dispositifs provenant d’un pays tiers, l’importateur doit veiller à la conformité aux exigences générales du règlement des dispositifs. Il doit vérifier que le fabricant s’est acquitté de la procédure d’évaluation de la conformité avant commercialisation.
Il aura également l’obligation d’apposer ses coordonnées sur le DM et de les ajouter dans la base de données EUDAMED, le respect de cette obligation devant être vérifiée par tout distributeur du produit.
Dans une perspective de protection de la santé et de la sécurité des patients et des utilisateurs finaux au sein du marché, il sera habilité à réaliser des tests par sondage, à enquêter sur les réclamations ainsi qu’à tenir un registre des réclamations concernant les DM importés. En cas de non-conformité ou de réclamation, l’importateur sera tenu de retirer le produit du marché.
Contrairement aux directives, le règlement consacre un statut particulier pour le distributeur. Il est défini comme « toute personne physique ou morale faisant partie de la chaîne d’approvisionnement, autre que le fabricant ou l’importateur, qui met un dispositif à disposition sur le marché, jusqu’au stade de sa mise en place ».
Le distributeur devra vérifier la conformité CE du produit concerné et il ne pourra mettre sur le marché que les dispositifs qu’il estime conformes aux exigences générales de performance et de sécurité prévu par le règlement. Il ne sera toutefois pas tenu d’une obligation d’étiquetage, à la différence de l’importateur.
Lorsqu’ils mettent un dispositif à disposition sur le marché, les distributeurs doivent, « dans le cadre de leur activité », agir « avec la diligence requise » pour respecter les exigences applicables. Le règlement ne définit pas ce qu’il faut entendre par « diligence requise ».
Il convient donc de se référer au Guide bleu relatif à la mise en œuvre de la réglementation de l’Union européenne sur les produits, édité par la Commission européenne, qui présente la diligence requise comme « l’effort consenti par une partie normalement prudente ou raisonnable pour éviter de porter préjudice à l’autre partie, compte-tenu des circonstances. Elle se réfère au niveau de jugement, d’attention, de prudence, de détermination et d’activité attendue raisonnablement d’une personne dans les circonstances particulières ». Le distributeur est donc soumis à une obligation de moyens renforcée en ce qui concerne les mesures qu’ils estiment nécessaires en cas de non-conformité d’un dispositif.
Quant à la question des responsabilités respectives des distributeurs et des importateurs, et des situations pouvant être à l’origine d’une requalification de ces derniers en fabriquant, cette question mériterait, à elle seule, un long article.
Ce qu’il convient de retenir, en définitive, c’est que le règlement accroît les obligations réglementaires des opérateurs économiques. Il crée de nouvelles responsabilités incombant également aux acteurs de la réglementation déjà établis, tels que les organismes notifiés et les autorités compétentes. Or, en garantissant une sécurité plus importante au consommateur, l’accroissement de ces obligations conduit en même temps à nuire à complexifier l’étendue des responsabilités et obligations des opérateurs économiques car il ne suffit pas d’examiner le texte. Il faut également le « faire vivre » et le confronter à la réalité des pratiques.
Les litiges impliquant des produits de santé témoigne généralement d’un contentieux en responsabilité tripartite, opposant utilisateurs finaux, opérateurs économiques et autorités de contrôle.
Il appartiendra aux juges nationaux et européens d’apprécier cette nouvelle clé de répartition des rapports entre les différents acteurs, que le règlement a introduite.
4.
La Commission européenne n’a pas attendu la presse pour dénoncer la manière dont les États membres de l’UE désignaient les organismes notifiés (ON). Manque de transparence dans les certifications des DM, manque d’intégrité, de compétence et/ou de rigueur des ON : les scandales sanitaires et l’absence d’uniformisation n’ont fait que rappeler l’urgence à réformer le système.
C’est précisément l’office du Règlement 2017/745 du 5 avril 2017.
S’agissant des modalités d’intervention de l’ON, tout fabricant de DM classés IIa, IIb, ou de classe III ainsi que ceux de la classe I mis sur le marché à l’état stérile, est tenu d’entamer une procédure d’évaluation de la conformité de son produit avant la mise sur le marché. C’est parmi les 65 ON de son choix que le fabricant doit déposer la demande de certification.
Le fabricant n’a plus la possibilité de contracter avec plusieurs ON simultanément, comme par le passé, pour faire évaluer le DM dans le but de multiplier ses chances d’obtention de la certification. Un seul contrat à la fois, l’ON étant tenu de présenter un devis au fabricant qui en forme la demande. C’est sans avoir à justifier de son choix que le fabricant pourra même changer d’ON, ce changement devant faire l’objet d’une information diffusée à toutes les instances de contrôle chargées de l’application du règlement. À la disposition de tous, la base EUDAMED en sera instruite en conséquence.
Dans une optique de transparence, les ON sont désormais tenues de rendre publique la liste de leurs redevances dites standards, facturées pour toute évaluation de la conformité de leurs DM à mettre ou mis sur le marché.
Le règlement renforce également le rôle des autorités de contrôle.
Les autorités compétentes, telles que l’ANSM en France, doivent contrôler de manière appropriée les caractéristiques et les performances des DM en matière de conformité, notamment, le cas échéant, par l’examen de la documentation et par des essais physiques ou en laboratoire sur la base d’échantillons adéquats et doivent tenir compte des principes établis en matière d’évaluation et de gestion des risques, ainsi que des données issues de la vigilance et des réclamations.
Elles élaborent des programmes annuels pour leurs activités de surveillance et y consacrent les ressources matérielles et humaines nécessaires pour pouvoir ces activités, et cela en conformité avec le programme européen de surveillance du marché mis au point par le groupe de coordination en matière de DM (GCDM).
Elles doivent encore établir un rapport annuel des résultats de leurs activités de surveillance et le mettre à la disposition des autres autorités compétentes via le système électronique de coopération entre États membres.
Le règlement institue de nouvelles autorités en matière de désignation et de contrôle des ON.
Toute personne physique ou morale candidate à l’agrément « organisme d’évaluation de la conformité des DM » formera sa demande auprès de l’autorité responsable (AR) des ON de son État d’origine, et nommée par ce dernier. L’AR sera chargée de la mise en place et du suivi des procédures nécessaires à l’évaluation, à la désignation et à la notification des organismes d’évaluation et la conformité et du contrôle des ON, ainsi que de leurs sous-traitants et filiales. Pèse sur ces AR l’obligation triennale de se soumettre au contrôle de leurs pairs afin d’évaluer leurs propres compétences sur le terrain.
Le GCDM étudie les candidatures des organismes postulant à la désignation d’ON. La Commission européenne fait également appel à un comité de trois experts, aussi appelé « équipe d’évaluation conjointe » pour diligenter parallèlement un audit d’évaluation des postulants à la nomination d’ON. Ces experts nommés par chaque État membre seront choisis dans la liste tenue électroniquement à jour par la Commission.
Retenons que le règlement a délibérément rendu le processus de désignation des ON complexe et collégial afin de se prémunir des défaillances passées.
On peut simplement regretter l’absence de sanctions pécuniaires ou d’une autre nature à l’encontre des ON qui bafoueraient le Règlement 2017/745. Leur désignation et leur surveillance relèvent toujours de la responsabilité nationale mais d’autres instances expertes au niveau européen participeront à leur évaluation et à leur contrôle.
Ce renforcement drastique des procédures de contrôle reste la condition indispensable à la restauration de la confiance sur le marché considérable des dispositifs médicaux.
L’auteur
Me Omar YAHIA
SELARL YAHIA Avocats
Barreau de Paris